TEMA
11.- CALOR Y TEMPERATURA
SIGUIENDO
EL LIBRO DE LA EDITORIAL ANAYA. Edición 2012
1.-LA
ENERGÍA TÉRMICA Y LA TEMPERATURA
2.- EL
CALOR: UNA ENERGÍA EN TRÁNSITO
3.-
EFECTOS DEL CALOR
4.-
PROPAGACIÓN DE CALOR
5.-
CONDUCTORES Y AISLANTES TÉRMICOS
6.- LAS
MÁQUINAS TÉRMICA
1.-LA
ENERGÍA TÉRMICA Y LA TEMPERATURA
La energía térmica es la energía que posee un
cuerpo (o un sistema material) debido al movimiento de las partículas que lo
componen.
La temperatura es una magnitud física que indica el estado
de agitación de las partículas o nivel térmico de un cuerpo. Si ponemos en
contacto dos cuerpos, siempre existe
un paso de energía térmica del cuerpo a mayor temperatura al que está a menor
temperatura, aunque este tenga mayor masa.
En el
sistema internacional de unidades (SI), la temperatura se mide en Kelvin.
Debemos observan que no decimos “grados” Kelvin, y que el símbolo K no va
precedido de 0 como
superíndice ya que es incorrecto.
La
energía térmica que contiene un cuerpo depende de su temperatura, pero también
de su masa.
LAS
ESCALAS TERMOMÉTRICAS
En la
vida cotidiana no utilizamos el kelvin,
sino la escala Celsius. En Estados Unidos, Gran Bretaña y otros países
de su influencia se utiliza la escala
Fahrenheit.
Las
tres escalas se caracterizan porque toman dos temperaturas fijas; una
corresponde a la temperatura normal (esto es, tomada a una atmósfera de
presión) de congelación del agua, y otra, a la temperatura normal de ebullición
del agua. La diferencia de una escala a otra deriva de los valores que se le
asignan a esas temperaturas.
•
Escala Celsius o centígrada
Se toman por acuerdo como puntos
fijos el punto de fusión del hielo y el punto de ebullición del agua. Una
escala termométrica vendrá definida por los valores de temperatura asignados a
los dos puntos, aceptando una variación lineal de la magnitud termométrica con
la temperatura.
La escala Celsius o centígrada
asigna el valor cero al punto de congelación o solidificación del agua y el
valor 100 al punto de ebullición de la misma a la presión de una atmósfera.
Cada unidad, debido a la variación lineal con la temperatura, será 1/100 del
intervalo y se llama grado Celsius o centígrado (°C).
•
Escala Kelvin o absoluta
La escala absoluta o
termodinámica utiliza como unidad de medida de temperatura el kelvin (K), cuyo
valor coincide exactamente con el de 1 °C, ya que el intervalo entre los puntos
fijos también se divide en 100 unidades. Sin embargo, se asigna el valor 273 al
punto de fusión del hielo y, por tanto, el valor 373 al punto de ebullición del
agua. En consecuencia, la relación entre la temperatura medida en Kelvin y la
medida en grados centígrados es la siguiente:
T (K) = t (°C) +
273
Es decir, se trata de la misma
escala que la centígrada pero desplazada hacia abajo en 273 unidades.
La importancia de la escala
absoluta radica en que es posible demostrar que el cero absoluto de temperatura
se corresponde con la ausencia total de energía cinética interna del cuerpo
considerado, es decir, con la inmovilidad total de sus partículas.
•
Escala Fahrenheit
Otra escala de temperaturas, muy
utilizada en Norteamérica fuera de los ambientes científicos es la escala
Fahrenheit. En esta escala se efectúan 180 divisiones en el intervalo definido
por los puntos fijos, asignando a estos puntos los valores 32 y 212, respectivamente.
La relación entre la temperatura
expresada en grados centígrados y la correspondiente en grados Fahrenheit.
t (°F) = 1,8 t (°C)
+ 32
•
Equivalencia entre las escalas Kelvin y
Celsius
T (K) = t + 273
La temperatura absoluta se
indica con T y la temperatura centígrada, con t (no confundir esta temperatura
con el tiempo, que también se simboliza con la letra t).

ACTIVIDADES:
1.- Un cuerpo A, se
encuentra a25ºC, y otro B, a 75ºF, ¿Cuál de los dos tiene mayor nivel térmico?.
2.- En los cálculos de un problema, un estudiante ha convertido cierto valor de temperatura a
la escala Fahrenheit, obteniendo -465ºF. ¿Es posible?.
MÁS ACTIVIDADES. .- Completa las siguientes tablas:
Centígrada
|
Fahrenheit
|
kelvin
|
200
|
||
40
|
||
400
|
Centígrada
|
Fahrenheit
|
Kelvin
|
-5ºC
|
||
20
|
||
450
|
||
100
|
||
80
|
2.- EL
CALOR: UNA ENERGÍA EN TRÁNSITO
Llamamos calor a la energía térmica que
transita de forma natural entre dos sistemas materiales que están a diferente
temperatura.
El
calor, es una energía en tránsito, no un tipo de energía de la que disponga un
sistema material. Es decir, los cuerpos no
tienen calor, tienen energía térmica.
El
calor se expresa en unidades de energía, que en el sistema internacional,
es el
julio, J.
Sin
embargo, por razones históricas se sigue utilizando la caloría, cal, siendo:
1
caloría = 4,18 J; 1 julio= 0,24 calorías
EL EQUILIBRIO
TÉRMICO
La medida de la temperatura como magnitud física adquiere
sentido a partir de la idea de equilibrio térmico.
Un sistema físico se
encuentra en equilibrio térmico con el ambiente que lo rodea si no intercambia
energía con él, lo cual implica que ambos se encuentran a la misma temperatura.
Si no lo están, es porque llevan en contacto menos tiempo
del necesario para que se alcance el equilibrio, pero si los dejamos juntos el
tiempo suficiente, acabarán por alcanzar la misma temperatura, llamada temperatura
de equilibrio.
Principio cero de la termodinámica
Si dos sistemas situados en contacto térmico con un tercero
están en equilibrio con él, entonces ambos sistemas están en equilibrio térmico
entre sí.


Ejemplo de equilibrio térmico
El recipiente 1 contiene 250 ml de agua a 50 °C y el
recipiente 2 contiene la misma cantidad de agua a 10 °C.
Al mezclar el contenido de ambos recipientes en otro recipiente
y medir la temperatura de la mezcla, observamos que al cabo de unos instantes
la temperatura es t3 = 30 °C, intermedia entre t1 y t2.
¿ES LO MISMO CALOR
QUÉ TEMPERATURA?
Calor y temperatura son dos magnitudes físicas distintas.
La temperatura es
la magnitud física que indica el estado de agitación de las partículas que
constituye un cuerpo. Su unidad en el SI
es el Kelvin, aunque utilizamos
habitualmente el grado Celsius.
El calor es una energía en tránsito entre dos cuerpos que se
encuentran a diferente temperatura. Su unidad en el SI es el Julio, J.
ACTIVIDADES:
1.- Explica qué es el calor. ¿Recibe otro nombre?.
2.- ¿Puede pasar el calor de los cuerpos fríos a los cuerpos
calientes?. ¿Por qué?.
3.- Ordena las siguientes letras para construir palabras que
estén relacionadas con este tema:
EGRENIA
TREMCIA
FETUNE
RIENESTCISA
FGEUO
4.- ¿A cuántos KJ equivale una
Kcal?
3.-
EFECTOS DEL CALOR
Cuando
se calienta un cuerpo aumenta la energía de sus partículas y se produce un
aumento de temperatura.
Este
aumento de temperatura depende de tres
factores:
-
La masa del cuerpo.
-
El tiempo que dura el calentamiento.
-
El tipo de sustancia considerada.
Cuanto mayor es la masa del cuerpo, más
pequeño es su aumento de temperatura.
Ejemplo, el agua de una piscina pequeña, al final del día estará más caliente
que el agua de una piscina grande, aunque las dos hayan recibido la misma
energía del Sol.
Cuanto mayor sea el tiempo de calentamiento,
más energía almacena el cuerpo y más
aumentan su temperatura.
Por eso, en verano el agua del mar está más
caliente que en invierno, ya que recibe más horas de Sol.
Cada sustancia tiene un calor
específico característico, es decir, cada sustancia necesita una cantidad de
calor determinada para que aumente un grado centígrado su temperatura.
Cuando un cuerpo intercambia
calor con su entorno, experimenta diversos cambios, que pueden ser físicos y
químicos.
CAMBIOS FÍSICOS:
Variación de la temperatura.- Si
un cuerpo recibe calor del entorno, aumenta la temperatura; por el contrario,
si cede calor a su entorno, disminuye la temperatura.
Cambio de estado de agregación
En algunas
circunstancias, cuando se aporta energía calorífica a un cuerpo, este no
aumenta su temperatura, sino que esa energía se invierte en modificar las
fuerzas que unen unas moléculas con otras, provocando que la materia cambie su
estado de agregación. Los cambios de estado más corrientes son sólido ↔ líquido
y líquido ↔ gas. Los cambios sólido ↔ gas son más raros y, en general, se
producen en circunstancias no ordinarias.

La materia se
presenta en tres estados: sólido, líquido y gaseoso. Según las condiciones
externas de presión y temperatura, un mismo cuerpo puede existir en cualquiera
de ellos.
Los cambios de
estado se caracterizan por lo siguiente:
No cambian la
naturaleza de la sustancia.
Se producen a
temperatura constante para cada presión.
La sustancia
absorbe o cede calor. El calor invertido en el proceso para la unidad de masa
recibe el nombre de calor latente de cambio de estado.
El valor de la
temperatura a la que se producen y el valor del calor latente correspondiente,
son característicos de cada cambio de estado y de la naturaleza de la
sustancia.
La energía
necesaria para que una sustancia cambie de estado es:
Q = m
· L
Donde m
es la masa de la sustancia considerada y L es una propiedad
característica de cada sustancia, llamada calor latente. El calor latente se
mide en J/kg en unidades del SI.
La
representación gráfica de la temperatura de un sistema físico en función del
tiempo, cuando el sistema absorbe o libera un calor constante por unidad de
tiempo, se llama gráfica de calentamiento o enfriamiento.

Fusión y solidificación son procesos
contrarios en el cambio de estado sólido ↔ líquido. Se producen a una
temperatura determinada para cada sustancia y su valor varia muy poco con la
presión.
La fusión de
una sustancia supone un cambio de su estructura e interacciones entre las
moléculas o unidades estructurales de la misma, y se efectúa con un aporte de
calor.
Las partículas
del sólido pueden vibrar. Si reciben energía, su energía cinética aumenta, y
con ello también lo hace la temperatura.
Llega un
momento en que el sólido se transforma en líquido. Mientras se está produciendo
el cambio de estado, la temperatura no varía, porque toda la energía que absorbe
el sólido se emplea en romper las fuerzas de cohesión entre las partículas, y
no en aumentar su velocidad.
Calor
latente de fusión, Lf, es la cantidad de calor necesaria para que, a
la temperatura de fusión y a la presión de 1 atmósfera, 1 kg de una sustancia
en estado sólido se transforme en líquido.
•
Vaporización y licuación
Una vez
completado el cambio de estado, si seguimos aportando calor, vuelve a
producirse un aumento de la agitación molecular, hasta que la velocidad de las
partículas es tan grande que pueden escapar de la superficie del líquido,
pasando a estado gaseoso.
Vaporización
es el cambio de estado de líquido a gas o vapor, también llamado ebullición.
El proceso contrario se llama licuación o condensación. El
proceso se efectúa a la temperatura constante de ebullición característica de
cada sustancia a una determinada presión.
Calor
latente de vaporización, Lv, es la cantidad de calor necesaria para
que, a la temperatura de ebullición y a la presión de 1 atmósfera, 1 kg de una
sustancia en estado líquido pase a vapor.
La temperatura
de ebullición depende de la presión. A mayor presión exterior, mayor será la
temperatura de vaporización y, si disminuye la presión, también lo hace la
temperatura del cambio de estado líquido → vapor de forma significativa.
•
La evaporación
El proceso por
el cual un líquido pasa lentamente al estado de vapor sin que se haya alcanzado
la temperatura de ebullición o vaporización a presión ordinaria, recibe el
nombre de evaporación.
La explicación
del proceso se hace a través de la teoría cinética de la materia, que supone
que las unidades componentes de la misma están en continuo, caótico y rápido
movimiento. Algunas de estas unidades (moléculas, por ejemplo) tienen la
suficiente energía para vencer la atracción del resto de las moléculas y pasar
a la atmósfera, o a la fase de vapor si la sustancia está en un recipiente
cerrado. La tendencia a pasar a la fase de vapor aumenta con la temperatura.
La rapidez con
que se efectúa el proceso depende de la superficie de evaporación, de la
temperatura, de la naturaleza del líquido y, en el caso del agua, de la humedad
relativa. Al ser un fenómeno de superficie, resulta independiente de la masa
total del líquido.

Variación en las dimensiones:
dilatación
Cuando un cuerpo recibe calor,
sus partículas se mueven más deprisa, por lo que necesitan más espacio para
desplazarse y, por tanto, el volumen del cuerpo aumenta. A este aumento de
volumen se le llama dilatación.

Dilatación en
sólidos.- Cuando
se calienta un sólido, se dilatan sus tres dimensiones.
Si tiene forma de varilla, su
longitud aumenta y se dice que ha experimentado una dilatación lineal.
El coeficiente de dilatación
lineal, α, es el alargamiento que experimenta la unidad de longitud de un
sólido, medido a 0 °C, cuando su temperatura se eleva a 1 °C.
Si el sólido tiene forma de
lámina, la dilatación afecta a sus dos dimensiones, y se llama dilatación
superficial.
El coeficiente de dilatación
cúbica, γ, representa el aumento de volumen de un sólido de volumen la unidad,
medido a 0 °C, cuando su temperatura se eleva a 1 °C.
γ = 3α.
Todos los coeficientes de
dilatación, α, β y γ dependen de cada material y se expresan en (°C)-1 en el
Sistema Internacional de unidades (SI).
CAMBIOS QUÍMICOS
El calor también puede provocar cambios más profundos en los
sistemas materiales cuando se calientan. Estos cambios se llaman cambios
químicos.
Los cambios químicos son aquellos en los que sí varía la
composición interna del sistema material. En ellos, unas sustancias puras, que
denominamos reactivos, se transforman en otras diferentes, llamadas productos.
En la vida cotidiana, estos efectos suelen ser muy
corrientes, ejemplo: si dejamos una fruta pelada encima de la mesa, con el
tiempo su aspecto cambia de forma notable. Esto es debido a que las sustancias
que componen la fruta reaccionan con el oxígeno del aire y se descomponen en
otras al recibir calor del entorno.
Estos procesos se denominan reacciones
químicas.
Las reacciones químicas
son muy importantes para la sociedad, ya que nos proporcionan diversos materiales y energía. Ejemplo, las reacciones de
combustión, la fotosíntesis, la oxidación, etc.
4.-
PROPAGACIÓN DE CALOR
-Cuando existe una diferencia de temperatura entre
dos cuerpos o entre dos partes de un mismo cuerpo, se establece espontáneamente
un transporte de calor que puede tener lugar por conducción, por convección o
por radiación.
Conducción
Si calentamos una barra metálica por un extremo, el calor se
transmite hasta el otro extremo. El transporte de energía se realiza partícula
a partícula; las partículas con mayor energía cinética ceden parte de su
energía a las partículas adyacentes. Pero no todos los cuerpos conducen el
calor por igual. Los metales conducen mejor el calor que los plásticos o la
madera.
En la conducción se transporta energía sin que haya
transporte de materia. De esta forma se transmite el calor en los sólidos.

Convección
Al calentar un recipiente que contiene agua, el calor se
reparte rápidamente por toda la masa del líquido; esto es debido a que, cuando
el agua del fondo se calienta, disminuye su densidad (se dilata) y sube a la
superficie, desplazando a las partículas de las zonas más frías, que bajan. Se
establecen corrientes de convección.
En la convección hay transporte de energía y de materia. Así
se transmite el calor en líquidos y gases.
Radiación
La energía se puede transportar de un cuerpo a otro sin que
haya contacto físico entre ellos. La energía del Sol llega a la Tierra a través
del vacío. Esta transmisión de energía se produce por radiación. Todos los
cuerpos emiten energía por radiación; la cantidad que irradian depende de la
diferencia de temperatura entre el cuerpo y el ambiente.
En la radiación, la energía pasa de un cuerpo a otro sin que
haya contacto entre ellos.

5.-
CONDUCTORES Y AISLANTES TÉRMICOS
Los metales conducen bastante bien el calor. Esto lo podemos
comprobar en verano, cuando tocamos una verja u otro objeto metálico expuesto
al sol y sentimos que nos quemamos. En este caso, como el metal es buen
conductor del calor, este pasa rápidamente hasta nuestra mano.
La sensación de frío que sucede en invierno al tocar la
misma verja tiene el mismo motivo. Pero en este caso el calor sigue un camino
inverso: desde nuestra mano hasta la verja.
Para cuantificar este carácter conductor del calor se emplea
la magnitud llamada conductividad térmica. Los metales y otros materiales que
conducen bien el calor tienen una conductividad térmica elevada. Los gases y la
fibra de vidrio, por ejemplo, son buenos aislantes del calor.
6.- LAS
MÁQUINAS TÉRMICA
Las máquinas térmicas son dispositivos que pueden producir
trabajo mecánico a partir de calor. El rendimiento de una máquina térmica es:
Rendimiento = Energía producida Energía consumida · 100 = W
Q 1

Tipos de máquinas
térmicas
Son los motores de combustión interna y las máquinas de
vapor.
Los motores de
combustión interna
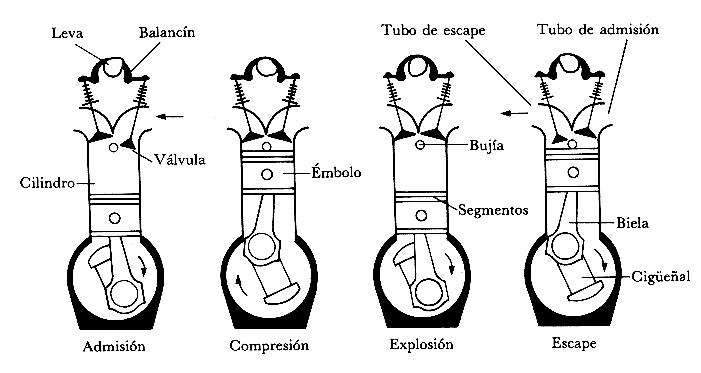
Los motores de combustión interna alternativos, vulgarmente conocidos como motores de explosión (gasolina) y motores diésel, son motores térmicos en los que los gases resultantes de un proceso de combustión empujan un émbolo o pistón, desplazándolo en el interior de un cilindro y haciendo girar un cigüeñal, obteniendo finalmente un movimiento de rotación.
El funcionamiento cíclico de estos motores implica la necesidad de sustituir los gases de la combustión por nueva mezcla de aire y combustible en el interior del cilindro; este proceso se denomina renovación de la carga.

La máquina de vapor
La primera máquina térmica eficiente fue la máquina de
vapor, desarrollada en el siglo XVIII para bombear agua de las minas en
Inglaterra.
Es una máquina de combustión externa; esto quiere decir que
la combustión se produce fuera del lugar donde se realiza el trabajo.
El resultado obtenido es el movimiento de algún elemento
(una rueda, generalmente). Es decir, a partir del calor generado en la caldera
se obtiene energía cinética que luego se transforma en otras formas de energía,
trabajo, etc.
Las centrales térmicas utilizan como combustible fuel-oil o
gas (centrales térmicas convencionales) o uranio (centrales nucleares). En
ellas, el vapor producido en la caldera mueve una turbina que hace girar el
generador.

LA REVOLUCIÓN INDUSTRIAL
No hay comentarios:
Publicar un comentario