8.1.- ¿DE QUÉ ESTÁ HECHO EL UNIVERSO?
8.2.- ESCALAS DE OBSERVACIÓN
8.3.- COMPOSICIÓN DE LA MATERIA
8.4.- LOS CAMBIOS EN LOS SITEMAS MATERIALES
8.5.- LOS SISTEMAS MATERIALES Y LA ENERGÍA
FINAL DEL TEMA 8 de la página 158 a la página 165:
Formulación y nomenclatura:
-Introducción
- Elementos
- Compuestos binarios: óxidos e hidruros
combinaciones no metal+ metal
actividades resueltas
8.1.- ¿DE QUÉ ESTÁ HECHO EL UNIVERSO?
El universo, que se encuentra en permanente cambio, podemos describirlo en términos de materia y energía.
Para poder estudiar la matería, empezaremos definiendo, qué es un sistema material.
Llamamos sistema material a cualquier forma de materia cuyos límites sean imprecisos, bien por su naturaleza, bien por su extensión; si tiene límites definidos, hablaremos de cuerpos.
Son sistemas materiales las nubes, el aire, el mar o las galaxias, mientras que una mesa o un coche son cuerpos.
Al mirar a nuestro alrededor, observamos que todo lo que nos rodea está constituido por materia. Por materia entendemos todo aquello que tienen dimensiones, es decir ocupa un lugar en el espacio, que se expresa mediante el volumen, cuya unidad en el sistema internacional (SI) es el metro cúbico (m3); y
presenta inercia, la inercia es la propiedad que tienen todos los cuerpos (o todo sistema material) a mantener su estaso de reposo o de movimiento. La cantidad de inercia que tiene un cuerpo vienen dada por su masa, cuya unidad en el sistema internacional (SI) es el kilogramo, Kg.
RESUMIENDO:
Todo lo que podemos ver y tocar es materia. También son materia cosas que no podemos ver, como el aire.
Observamos que la materia ocupa una cierta porción de espacio que llamamos volumen.
Esta es una propiedad general de la materia: la materia ocupa volumen.
Otra propiedad esencial es que la materia tiene masa, lo que comprobamos cada vez que pesamos distintos objetos con una balanza.
No sólo lo que está a nuestro alcance es materia. También es materia lo que constituye los planetas, el Sol y las demás las estrellas, las galaxias... Y a escala microscópica, son también materia las células, los virus, el ADN...
Podemos decir que es materia todo lo que ocupa volumen y tiene masa. La materia forma todos los cuerpos del universo.
ES LA CAUSA DE LA ATRACCIÓN GRAVITATORIA
Debido a ella, los cuerpos o los sistemas materiales se atraen entre sí. La atracción gravitatoria es responsable de:
- La formación de los planetas, las estrellas y las galaxias, al ir atrayéndose y compactándose diversas cantidades de materia.
- Que los planetas se muevan alrededor del Sol ( o de su estrella)
- La formación de las mareas.
- Que los cuerpos que soltamos caigan de forma espontánea hacia abajo
http://cplosangeles.juntaextremadura.net/web/edilim/curso_4/cmedio/la_materia/la_materia/la_materia.html
http://newton.cnice.mec.es/materiales_didacticos/materia/index.html
http://www.profesorenlinea.cl/fisica/Materia1.htm
8.2.- Escalas de observación macro y microscópica
Antes de nada debemos familiarizarnos con el denominado SI (Sistema Internacional de medidas). Se trata del nombre que recibe el sistema de unidades que se usa en la mayoría de los países y es la forma actual del sistema métrico decimal. El SI también es conocido como «sistema métrico», especialmente en las naciones en las que aún no se ha implantado para su uso cotidiano. Fue creado en 1960 por la Conferencia General de Pesos y Medidas, que inicialmente definió seis unidades físicas básicas. En 1971 se añadió la séptima unidad básica, el mol.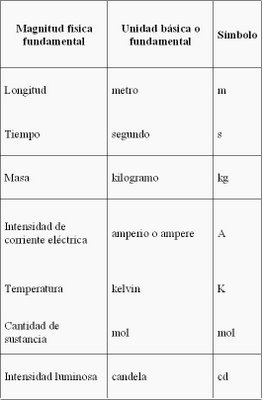
Metro (m). Unidad de longitud. Definición: un metro es la longitud de trayecto recorrido en el vacío por la luz durante un tiempo de 1/299 792 458 de segundo.
Kilogramo (kg). Unidad de masa. Definición: un kilogramo es una masa igual a la almacenada en un prototipo.
Segundo (s). Unidad de tiempo. Definición: el segundo es la duración de 9 192 631 770 periodos de la radiación correspondiente a la transición entre los dos niveles hiperfinos del estado fundamental del átomo de cesio 133.
Ampere o amperio (A). Unidad de intensidad de corriente eléctrica. Definición: un amperio es la intensidad de una corriente constante que manteniéndose en dos conductores paralelos, rectilíneos, de longitud infinita, de sección circular despreciable y situados a una distancia de un metro uno de otro en el vacío, produciría una fuerza igual a 2•10-7 newton por metro de longitud.
Kelvin (K). Unidad de temperatura termodinámica.Definición: un kelvin es la temperatura termodinámica correspondiente a la fracción 1/273,16 de la temperatura termodinámica del punto triple del agua.
Mol (mol). Unidad de cantidad de sustancia. Definición: un mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 0,012 kilogramos de carbono 12. Cuando se emplea el mol, es necesario especificar las unidades elementales, que pueden ser átomos, moléculas, iones, electrones u otras partículas o grupos especificados de tales partículas.
Candela (cd). Unidad de intensidad luminosa. Definición: una candela es la intensidad luminosa, en una dirección dada, de una fuente que emite una radiación monocromática de frecuencia 540•1012 hercios y cuya intensidad energética en dicha dirección es 1/683 vatios por estereorradián.
En el Sistema Internacional la unidad de medida es el metro . Pero dependiendo del tamaño de la magnitud nos vemos obligados a utilizar algunos de sus múltiplos o divisores.
Así tendremos que familiarizarnos también con los prefijos más comunes que adheridos a la unidad de medida indican las fracciones o multiplicaciones correspondientes:
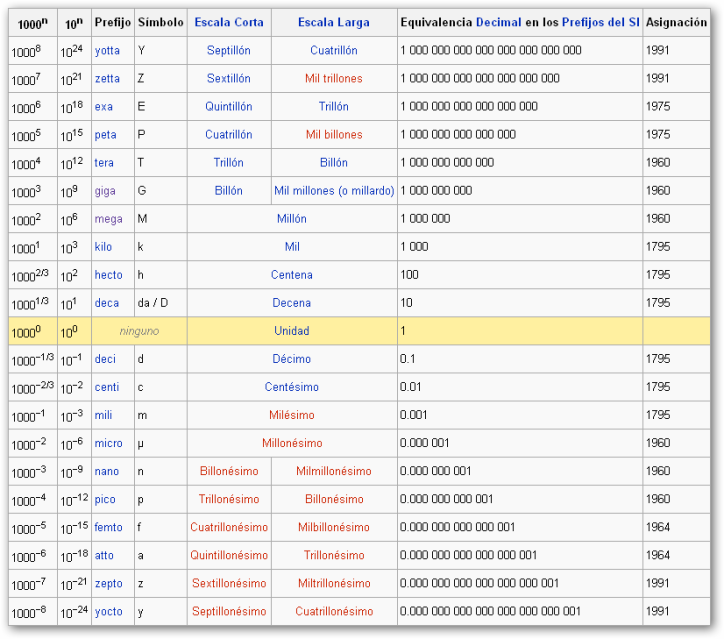
Según las dimensiones de los objetos y las distancias, se consideran distintas escalas de observación:
-Observación microscópica: cuando hablamos de objetos y distancias no apreciables por el ojo humano. (por ejemplo: 10 nanómetro)
-Observación macroscópica: objetos y distancias apreciables a simple vista. (por ejemplo ( 10 mm)
Observación a escala astronómica, referida al Cosmos, con unos ordenes de magnitud muy superiores a la escala humana. (por ejemplo: 10 años-luz). Un año luz es la distancia que recorre la luz en un año. Más específicamente, es la distancia que recorrería un fotón en el vacío a una distancia infinita de cualquier campo gravitacional o campo magnético, en un año Juliano (365,25 días de 86.400 s)
Un año luz equivale aproximadamente a 9,46 × 1012 km, o sea 9.460.500.000.000 km (poco menos de diez billones de km).
http://intercienciasnaturales.wordpress.com/2009/11/13/esscalas-de-observacion-macro-y-microscopica/
Si quieres practicar puedes hacer estos ejercicios
http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_i/ejercicios/ejercicios_de_conversion.htm
La materia que vemos a nuestro alrededor está compuesta de átomos y moléculas, que estan a su vez formados por átomos. Así, una molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno. En la naturaleza hay 90 elementos químicos estables, representados por el átomo correspondiente. Todos estos átomos tienen la misma estructura básica: un núcleo de protones y neutrones alrededor del cual orbitan uno o varios electrones, dependiendo del elemento. El hidrógeno, el elemento químico mas sencillo, tiene como núcleo un solo protón alrededor del cual orbita un electrón; en el caso del helio, el núcleo tiene dos protones y dos neutrones, alrededor de los cuales hay dos electrones. A un nivel aun mas fundamental, los protones y neutrones estan formados por combinaciones de los quarks up y down.
8.3.- COMPOSICIÓN DE LA MATERIA
EL ÁTOMO Y LOS ELEMENTOS QUÍMICOS
En química y física, átomo (del latín atomum, y éste del griego
El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas pequeñas.
Estructura atómica
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleones, alrededor del cual se encuentra una nube de electrones de carga negativa.
El núcleo atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
- Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 Ã- 10–27 kg y una masa 1837 veces mayor que la del electrón.
- Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 Ã- 10–27 kg).
LOS ELEMENTOS QUÍMICOS
Un elemento químico, es una sustancia formada por átomos que tienen igual
cantidad de protones en el núcleo. Este número se conoce como el número atómico
del elemento.
Por ejemplo, todos los
átomos con 6 protones en sus núcleos son átomos del elemento químico carbono, mientras que todos los átomos con 92 protones en sus núcleos son átomos del elemento uranio.
Aunque, por tradición, se puede definir
elemento químico a cualquier sustancia que no puede ser descompuesta mediante
una reacción química en otras más simples.
Una definición
más sencilla dice que un elemento químico es un tipo particular de átomo, por
ejemplo: hidrógeno, helio, hierro, nitrógeno, oxigeno y otros.
Según lo anterior, también podría decirse que elemento químico es una sustancia pura constituida por una sola clase de átomos. Se representa mediante símbolos.
Ejemplos: sodio Na, potasio Ka, hierro Fe, Coro Cl, etc...
Es importante diferenciar elemento químico de sustancia simple. El ozono (O3) y el dioxígeno (O2) son dos sustancias simples, cada una de ellas con propiedades diferentes. Y el elemento químico que forma estas dos sustancias simples es el oxígeno (O). Otro ejemplo es el del elemento químico Carbono, que se presenta en la naturaleza como grafito o como diamante.
Según lo anterior, también podría decirse que elemento químico es una sustancia pura constituida por una sola clase de átomos. Se representa mediante símbolos.
Ejemplos: sodio Na, potasio Ka, hierro Fe, Coro Cl, etc...
Es importante diferenciar elemento químico de sustancia simple. El ozono (O3) y el dioxígeno (O2) son dos sustancias simples, cada una de ellas con propiedades diferentes. Y el elemento químico que forma estas dos sustancias simples es el oxígeno (O). Otro ejemplo es el del elemento químico Carbono, que se presenta en la naturaleza como grafito o como diamante.
Se conocen más de 118 elementos. Algunos
se han encontrado en la naturaleza, formando parte de sustancias simples o de
compuestos químicos. Otros han sido creados artificialmente en los
laboratorios. Estos últimos son inestables y sólo existen durante milésimas de
segundo.
Los elementos químicos se encuentran
clasificados en la Tabla Periódica
de los Elementos.
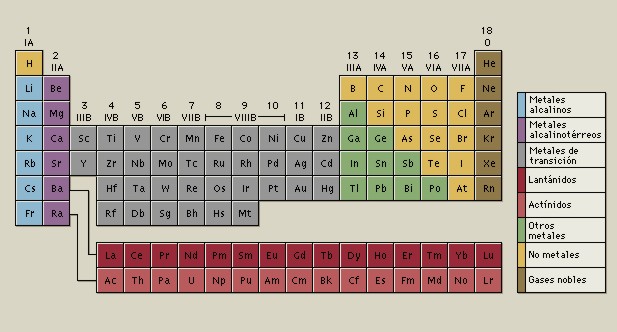
CLASIFICACIÓN DE LOS ELEMENTOS
Los metales se caracterizan por su apariencia brillante, capacidad para cambiar de forma sin romperse (maleables) y una excelente conductividad del calor y la electricidad.
Los no metales se caracterizan por carecer de estas propiedades físicas aunque hay algunas excepciones (por ejemplo, el yodo sólido es brillante; el grafito, es un excelente conductor de la electricidad; y el diamante, es un excelente conductor del calor).
Las características químicas son: los metales tienden a perder electrones para formar iones positivos y los no metales tienden a ganar electrones para formar iones negativos. Cuando un metal reacciona con un no metal, suele producirse transferencia de uno o más electrones del primero al segundo.
Propiedad de los metales
Poseen bajo potencial de ionización y alto peso específico
Por regla general, en su último nivel de energía tienen de 1 a 3 electrones.
Son sólidos a excepción del mercurio (Hg), galio (Ga), cesio (Cs) y francio (Fr), que son líquidos
Presentan aspecto y brillo metálicos
Son buenos conductores del calor y la electricidad
Son dúctiles y maleables, algunos son tenaces, otros blandos
Se oxidan por pérdida de electrones
Su molécula está formada por un solo átomo, su estructura cristalina al unirse con el oxígeno forma óxidos y éstos al reaccionar con el agua forman hidróxidos
Los elementos alcalinos son los más activos
Propiedades generales de los no-metales
Tienen tendencia a ganar electrones
Poseen alto potencial de ionización y bajo peso específico
Por regla general, en su último nivel de energía tienen de 4 a 7 electrones
Se presentan en los tres estados físicos de agregación
No poseen aspecto ni brillo metálico
Son malos conductores de calor y la electricidad
No son dúctiles, ni maleables, ni tenaces
Se reducen por ganancia de electrones
Sus moléculas están formadas por dos o más átomos
Al unirse con el oxígeno forman anhídridos y éstos al reaccionar con el agua, forman oxiácidos
Los halógenos y el oxígeno son los más activos
Varios no-metales presentan alotropía
La mayoría de los elementos se clasifican como metales. Los metales se encuentran del lado izquierdo y al centro de la tabla periódica. Los no metales, que son relativamente pocos, se encuentran el extremo superior derecho de dicha tabla. Algunos elementos tienen comportamiento metálico y no metálico y se clasifican como metaloides y semimetales.
Los no metales también tienen propiedades variables, al igual que los metales. En general los elementos que atraen electrones de los metales con mayor eficacia se encuentran en el extremo superior derecho de la tabla periódica.
Tabla Periódica
El ruso Dimitri Mendeleev y el alemán Julio Lotear Meyer trabajando por separado, llegaron a ordenar los elementos químicos, basándose en sus propiedades físicas y químicas.
La tabla periódica larga fue propuesta por Alfred Warner y Henry Moseley fue quien propuso que para la orden de los elementos fuera el número atómico y no el peso atómico.
http://www.profesorenlinea.cl/Quimica/TablaPeriodica.htm
Breve descripción de las propiedades y aplicaciones de algunos elementos de la Tabla Periódica.
Gases nobles o gases raros
Los gases nobles, llamados también raros o inertes, entran, en escasa proporción, en la composición del aire atmosférico. Pertenecen a este grupo el helio, neón, argón, criptón, xenón y radón, que se caracterizan por su inactividad química, puesto que tienen completos sus electrones en la última capa. No tienen tendencia por tanto, ni a perder ni a ganar electrones. De aquí que su valencia sea cero o que reciban el nombre de inertes, aunque a tal afirmación se tiene hoy una reserva que ya se han podido sintetizar compuestos de neón, xerón o kriptón con el oxígeno, el flúor y el agua.
El helio se encuentra en el aire; el neón y el kriptón se utilizan en la iluminación por sus brillantes colores que emiten al ser excitados, el radón es radioactivo.
Grupo I, metales alcalinos
Los metales alcalinos son aquellos que se encuentran en el primer grupo dentro de la tabla periódica.
Con excepción del hidrógeno, son todos blancos, brillantes, muy activos, y se les encuentra combinados en forma de compuestos. Se les debe guardar en la atmósfera inerte o bajo aceite.
Los compuestos de los metales alcalinos son isomorfos, lo mismo que los compuestos salinos del amonio. Este radical presenta grandes analogías con los metales de este grupo.
Estos metales, cuyos átomos poseen un solo electrón en la capa externa, son monovalentes. Dada su estructura atómica, ceden fácilmente el electrón de valencia y pasan al estado iónico. Esto explica el carácter electropositivo que poseen, así como otras propiedades.
Los de mayor importancia son el sodio y el potasio, sus sales son empleadas industrialmente en gran escala.
Grupo II, metales alcalinotérreos
Se conocen con el nombre de metales alcalinotérreos los seis elementos que forman el grupo IIA del sistema periódico: berilio, magnesio, calcio, estroncio, bario y radio. Son bivalentes y se les llama alcalinotérreos a causa del aspecto térreo de sus óxidos.
El radio es un elemento radiactivo.
Estos elementos son muy activos aunque no tanto como los del grupo I. Son buenos conductores del calor y la electricidad, son blancos y brillantes.
Como el nombre indica, manifiestan propiedades intermedias entre los metales alcalinos y los térreos; el magnesio y, sobre todo, el berilio son los que más se asemejan a estos.
No existen en estado natural, por ser demasiado activos y, generalmente, se presentan formando silicatos, carbonatos, cloruros y sulfatos, generalmente insolubles.
Estos metales son difíciles de obtener, por lo que su empleo es muy restringido.
Grupo III, familia del boro
El boro es menos metálico que los demás. El aluminio es anfótero. El galio, el indio y el talio son raros y existen en cantidades mínimas. El boro tiene una amplia química de estudio.
Grupo IV, Familia del carbono
El estudio de los compuestos del carbono corresponde a la Química Orgánica. El carbono elemental existe como diamante y grafito.
El silicio comienza a ser estudiado ampliamente por su parecido con el carbono. Los elementos restantes tienen más propiedades metálicas.
Grupo V, familia del nitrógeno
Se considera a este grupo como el más heterogéneo de la tabla periódica. El nitrógeno está presente en compuestos tales como las proteínas, los fertilizantes, los explosivos y es constituyente del aire. Como se puede ver, se trata de un elemento tanto benéfico como perjudicial. El fósforo tiene ya una química especial de estudio, sus compuestos son generalmente tóxicos. El arsénico es un metaloide venenoso. El antimonio tiene gran parecido con el aluminio, sus aplicaciones son más de un metal.
Grupo VI, Colágenos
Los cinco primeros elementos son no-metálicos, el último, polonio, es radioactivo. El oxígeno es un gas incoloro constituyente del aire. El agua y la tierra. El azufre es un sólido amarillo y sus compuestos por lo general son tóxicos o corrosivos. La química del teluro y selenio es compleja.
Grupo VII, halógenos
El flúor, el cloro, el bromo, el yodo y el astato, llamados metaloides halógenos, constituyen el grupo de los no metales monovalentes. Todos ellos son coloreados en estado gaseoso y, desde el punto de vista químico, presentan propiedades electronegativas muy acusadas, de donde se deriva la gran afinidad que tienen con el hidrógeno y los metales.
Los formadores de sal se encuentran combinados en la naturaleza por su gran actividad. Las sales de estos elementos con los de los grupos I y II están en los mares. Las propiedades de los halógenos son muy semejantes. La mayoría se sus compuestos derivados son tóxicos, irritantes, activos y tienen gran aplicación tanto en la industria como en el laboratorio.
El astatinio o ástato difiere un poco del resto del grupo.
Elementos de transición
Esta es una familia formada por los grupos IIIB, IVB, VB, VIB, VIIB, IB y IIB, entre los que se encuentran los elementos cobre, fierro, zinc, oro, plata, níquel y platino.
Las características de los metales de transición son muy variadas, algunos se encuentran en la naturaleza en forma de compuestos; otros se encuentran libres
Estos elementos no son tan activos como los representativos, todos son metales y por tanto son dúctiles, maleables, tenaces, con altos puntos de fusión y ebullición, conductores del calor y la electricidad. Poseen orbitales semilleros, y debido a esto es su variabilidad en el estado de oxidación.
ALGUNOS ELEMENTOS QUE CAUSAN CONTAMINACIÓN
En la naturaleza existen algunos elementos que debido a su estructura o en combinación con otros en forma de compuestos, son perjudiciales al hombre, ya que son agentes contaminadores del medio ambiente; en especial del aire, agua y suelo, o bien, porque ocasionan daños irreversibles al ser humano, como la muerte.
Algunos de estos elementos son:
Antimonio (Sb) y textiles.- Se emplea en aleaciones, metal de imprenta, baterías, cerámica. El principal daño que provoca es el envenenamiento por ingestión o inhalación de vapores, principalmente por un gas llamado estibina SbH3.
Arsénico (As) medicamentos y vidrio. Se emplea en venenos para hormigas, insecticidas, pinturas, Es uno de los elementos más venenosos que hay, así como todos los compuestos.
Azufre (S) Principalmente son óxidos SO2 y SO3 contaminan el aire y con agua producen la lluvia ácida. Sustancias tales como derivados clorados de azufre, sulfatos y ácidos son corrosivos. El gas H2S es sumamente tóxico y contamina el aire. El azufre es empleado en algunos medicamentos para la piel.
Bromo (Br) Sus vapores contaminan el aire, además sus compuestos derivados son lacrimógenos y venenosos.
Cadmio (Cd) Metal tóxico que se origina en la refinación del zinc; también proviene de operaciones de electrodeposición y por tanto contamina el aire y el agua. Contenido en algunos fertilizantes contamina el suelo.
Cloro (Cl) Sus valores contaminan el aire y son corrosivos. Se le emplea en forma de cloratos para blanquear la ropa, para lavados bucales y fabricación de cerillos. Los cloratos son solubles en agua y la contaminan, además de formar mezclas explosivas con compuestos orgánicos.
Los valores de compuestos orgánicos clorados como insecticidas, anestésicos y solventes dañan el hígado y el cerebro. Algunos medicamentos que contienen cloro afectan el sistema nervioso.
Cromo (Cr) El cromo y sus compuestos son perjudiciales al organismo, pues destruyen todas las células. Se le emplea en síntesis orgánicas y en la industria del acero. Cualquier cromato solubles contamina el agua.
Magnesio (Mn) Se emplea en la manufactura de acero y de pilas secas. La inhalación de polvos y humos conteniendo magnesio causa envenenamiento. También contamina el agua y atrofia el cerebro.
Mercurio (Hg) Metales de gran utilidad por ser líquidos; se utiliza en termómetros y por ser buen conductos eléctrico se emplea en aparatos de este tipo, así como en iluminación, pinturas fungicidas, catalizadores, amalgamas dentales, plaguicidas, etc. pero contamina el agua, el aire y causa envenenamiento. Las algas lo absorben, luego los peces y finalmente el hombre. Los granos o semillas lo retienen y finalmente el hombre los come.
Plomo (Pb) El plomo se acumula en el cuerpo conforme se inhala del aire o se ingiere con los alimentos y el agua. La mayor parte del plomo que contamina el aire proviene de las gasolinas para automóviles, pues se le agrega para proporcionarle propiedades antidetonantes. También se le emplea en pinturas, como metal de imprenta, soldaduras y acumuladores. Por su uso el organismo se afecta de saturnismo. Sus sales, como el acetato, son venenosas.
Existen otros elementos que de alguna forma contaminan el agua, el aire y el suelo tales como: talio, zinc, selenio, oxígeno de nitrógeno, berilio, cobalto y sobre todo gran cantidad de compuestos que tienen carbono. (Orgánicos).
Aluminio (Al): Metal ligero, resistente a la corrosión y al impacto, se puede laminar e hilar, por lo que se le emplea en construcción, en partes de vehículos, de aviones y en artículos domésticos. Se le extrae de la bauxita.
Azufre (S): No metal, sólido de color amarillo, se encuentra en yacimientos volcánicos y aguas sulfuradas. Se emplea en la elaboración de fertilizantes, medicamentos, insecticidas, productos químicos y petroquímicos.
Cobalto (Co): Metal color blanco que se emplea en la elaboración de aceros especiales debido a su alta resistencia al calor, corrosión y fricción. Se emplea en herramientas mecánicas de alta velocidad, imanes y motores. En forma de polvo se emplea como pigmento azul para el vidrio. Es catalizador. Su isótopo radiactivo se emplea como pigmento azul para el vidrio. Es catalizador
Cobre (Cu): Metal de color rojo que se carbonata al aire húmedo y se pone verde, conocido desde la antigüedad. Se emplea principalmente como conductor eléctrico, también para hacer monedas y en aleaciones como el latón y el bronce.
Hierro (Fe): Metal dúctil, maleable de color gris negruzco, se oxida al ocntacto con el aire húmedo. Se extrae de minerales como la hematina, limonita, pirita, magnetita y siderita. Se le emplea en la industria arte y medicina. Para fabricar acero, cemento, fundiciones de metales no ferrosos nuestra sangre lo contiene en la hemoglobina.
Flúor (F): Este no metal esta contenido en la fluorita CaF2 en forma de vetas encajonadas en calizas. La florita se emplea como fundente en hornos metalúrgicos. Para obtener HF, NHF4 y grabar el vidrio; también en la industria química, cerámica y potabilización del agua.
Fósforo (P): Elemento no metálico que se encuentra en la roca fosfórica que contiene P2 O5 en la fosforita Ca3 (PO4)2. Los huesos y dientes contienen este elemento.
Tiene aplicaciones para la elaboración de detergentes, plásticos, lacas, pinturas, alimentos para ganado y aves.
Mercurio (Hg): Metal líquido a temperatura ambiente, de calor blanco brillante, resistente a la corrosión y buen conductor eléctrico. Se le emplea en la fabricación de instrumentos de precisión, baterías, termómetros, barómetros, amalgamas dentales, sosa cáustica, medicamentos, insecticidas y funguicidas y bactericidas.
Se le obtiene principalmente del cinabrio que contiene HgS.
Plata (Ag): Metal de color blanco, su uso principal ha sido el la acuñación de monedas y manufacturas de vajillas y joyas. Se emplea en fotografía, aparatos eléctricos, aleaciones, soldaduras.
Plomo (Pb): Metal blando de bajo punto de fusión, bajo límite elástico, resistente a la corrosión, se le obtiene del sulfuro llamado galena Pbs. Se usa en baterías o acumuladores, pigmentos de pinturas, linotipos. Soldaduras e investigaciones atómicas. Otros productos que se pueden recuperar de los minerales que lo contiene son: cadmio, cobre, oro, plata, bismuto, arsénico, telurio y antimonio.
Oro (Au): Metal de color amarillo, inalterable, dúctil, brillante, por sus propiedades y su rareza le hace ser excepcional y de gran valor. Es el patrón monetario internacional. En la naturaleza se encuentra asociado al platino, a la plata y teluro en unos casos. Sus aleaciones se emplean en joyería y ornamentos, piezas dentales, equipos científicos de laboratorio. Recientemente se ha sustituido sus usos en joyería por el iridio y el rutenio, en piezas dentales por platino y paladio.
Uranio (U): Utilizado como combustible nuclear, es un elemento raro en la naturaleza y nunca se presenta en estado libre. Existen 150 minerales que lo contienen. El torio se encuentra asociado al uranio.
SUSTANCIAS PURAS
Las sustancias
puras son aquellas que están formadas por
partículas iguales.
Tienen propiedades especificas
bien definidas. Estas propiedades no varían, aun cuando dicha sustancia
pura se encuentre formando parte de una mezcla.
Algunas de estas propiedades
son:
|
|
|
Por ejemplo, el agua líquida
tiene una densidad de 1 g/cm3,y esta propiedad se mantiene constante, incluso
si el agua forma pare de una disolución.
Son sustancias puras el
agua, el alcohol, el nitrógeno, el oxígeno,...
ELEMENTOS Y COMPUESTOS
http://recursostic.educacion.es/secundaria/edad/3esofisicaquimica/impresos/quincena7.pdf
Compuestos químicos. Son sustancias puras que se pueden descomponer en otras más simples por métodos químicos.Estas sustencias están formadas por más de un elemento químico, ejemplo:NaCl.
Los elementos químicos son sustancias puras que no pueden descomponerse en otras más simples.Ejemplo Cl, Zn
SUSTANCIAS ATÓMICAS, MOLECULARES E IÓNICAS ...
Las sustancias metálicas tienen puntos de fusión variables, desde bajos hasta altos, pero son todas sólidas a temperatura ambiente, con la excepción del mercurio. Su dureza también es variable. Forman estructuras cristalinas regulares. Son sustancias que conducen bien la corriente eléctrica y no son solubles en ningún líquido.
Las sustancias covalentes tienen puntos de fusión muy altos, por lo que en todos los casos son sólidas a temperatura ambiente, formando estructuras cristalinas regulares. Son muy duras, insolubles en cualquier líquido y no conductoras de la corriente eléctrica.
Las sustancias iónicas tienen puntos de fusión medios o altos, siendo siempre sólidas a temperatura ambiente, formando también estructuras cristalinas regulares. Tienen una dureza media, y son solubles en mayor o menor medida en agua. En estado sólido no conducen la corriente eléctrica, pero sí lo hacen al fundirlas o al disolverlas en agua.
Las sustancias moleculares tienen puntos de fusión bajos, pudiendo ser sólidas, líquidas o gaseosas a temperatura ambiente. En estado sólido pueden forman estructuras cristalinas, o masas sólidas sin formas regulares. Son sustancias blandas, con solubilidad variable y que no conducen la corriente eléctrica.
Utilizando estos criterios experimentales es sencillo clasificar una sustancia concreta dentro de un grupo. Por ejemplo, si una sustancia es gaseosa a temperatura ambiente, es seguro que se trata de una sustancia molecular. Y si conduce bien la corriente eléctrica, casi puedes asegurar que se trata de un metal.
8.4.- LOS CAMBIOS EN LOS SISTEMAS MATERIALES
CONCEPTO DE CAMBIO.- Un cambio o fenómeno , es cualquier transformación que tenga lugar en un sistema material o en un cuerpo, y que podamos medir.
POR QUÉ SE PRODUCEN CAMBIOS.- Un sistema material o un cuerpo experimenta un cambio porque interacciona con otro o consigo mismo. En todo cambio tiene lugar un intercambio de energía. Las interacciones pueden ser: gravitatorias, electromagnéticas o nucleares.
TIPOS DE CAMBIO.- Un sistema material o cuerpo puede experimentar con el paso del tiempo dos tipos de cambios: físicos, químicos.
http://www.slideshare.net/KaterinGarca/cambios-fisicos-y-cambios-quimicos-de-la-materia
CAMBIOS FÍSICOS.-
Fenómenos o Cambios Físicos: Son procesos en los que no cambia
la naturaleza de las sustancias ni se forman otras nuevas.
Pueden ser de:
DE MOVIMIENTO
TÉRMICOS
ELÉCTRICOS
LUMINOSOS Y SONOROS
Ejemplos:
Cambios de estado: Si
aplicamos una fuente de calor de forma constante, el agua hierve y se
transforma en vapor de agua. (En ambos casos, la sustancia implicada en el
proceso es agua que, en un caso está líquida y en el otro está gaseosa; esto
es, sus partículas están ordenadas de diferente manera según la teoría
cinética de la materia).
Mezclas: Si disolvemos sal en
agua observaremos que la sal se disuelve fácilmente en agua y la disolución
resultante presenta un gusto salado. (Las sustancias iniciales - sal y agua -
siguen presentes al final; este hecho es demostrable pues si calentamos la
disolución hasta que hierva el agua, nos queda la sal en el fondo.
-
Fenómenos o Cambios Químicos: Son procesos en los que cambia la naturaleza de las sustancias, además de formarse otras nuevas. Ejemplos:
-
Combustión: Si quemamos un papel, se transforma en cenizas y, durante el proceso, se desprende humo. (Inicialmente, tendríamos papel y oxígeno, al concluir el cambio químico tenemos cenizas y dióxido de carbono, sustancias diferentes a las iniciales).
-
Corrosión: Si dejamos un trozo de hierro a la intemperie, se oxida y pierde sus propiedades iniciales. (Las sustancias iniciales serían hierro y oxígeno, la sustancia final es óxido de hierro, con unas propiedades totalmente diferentes a las de las sustancias iniciales).
Cuando se
produce una reacción química suelen producirse algunos indicios típicos:
- Cambio
de coloración: Indica la aparición de una o de varias sustancias nuevas
distintas a las iniciales.
-
Aparición de sedimento o precipitado: Es señal de que una o algunas de las
sustancias nuevas formadas son insolubles.
-
Desprendimiento de gas: Como resultado de la reacción aparece una nueva
sustancia que se presenta en estado gaseoso a temperatura ambiente.
-
Absorción o liberación de calor: Los cambios espontáneos de temperatura de
la mezcla revelan que se está produciendo una reacción.
- Cambios
en otras propiedades: La acidez, el olor, la aparición de propiedades
ópticas frente a la luz, propiedades magnéticas o eléctricas, etc.
¿Cómo se representan las reacciones químicas?
Una reacción química es un proceso en
que, a partir de unas sustancias iniciales, llamadas reactivos, se
obtienen unas sustancias finales distintas, llamadas productos.
Reactivos: Son las sustancias
iniciales que, una vez mezcladas, reaccionan químicamente.
Productos: Son las sustancias
nuevas que se forman como resultado de la reacción química entre los reactivos.
Las reacciones químicas se escriben
mediante ecuaciones químicas: a la izquierda se escriben los reactivos
que se mezclan, separados por signos de sumar (+) y, a la derecha, los productos
que se obtienen, separados también por signos de sumar (+). Entre reactivos y
productos se coloca una flecha, que indica el sentido de la reacción.
REACTIVOS
→ PRODUCTO
Fe + O2
→ FeO
Si quieres ampliar :http://www.quimicaweb.net/grupo_trabajo_ccnn_2/tema6/
8. 5.- LOS SISTEMAS MATERIALES Y LA ENERGÍA
Cualquier cambio conlleva siempre un intercambio de energía con su entorno, y a veces, también de materia.
Por entorno entendemos el exterior o alrededores, que rodea al sistema material o al cuerpo que estamosmestudiando.
CLASIFICACIÓN DE LOS SISTEMASMATERIALES
Según sea la relación de un sistema material con su entorno,los sitemas materiales se clasifican en :
Abiertos.- Son aquellos que pueden intercambiar tanto materia como energía con su entorno.
Cerrados.- Son aquellos que solo intercambian energía con su entorno.
Aislados.- Son aquellos que no pueden intercambiar ni materia ni energia con su entorno
La energía esta presente en sus diversas formas en cualquier sistema material que existe en el universo.
Repasando !
http://www.pucpr.edu/facultad/itorres/quimica105/Capmateria.htm
FORMULACIÓN Y NOMENCLATURA:
Puedes estudiarlo con el libro o con los apuntes que aparecen en estas páginas
https://dl.dropboxusercontent.com/u/43877103/2%C2%BA%20ESO/elementos%20y%20compuestos.pdf
https://dl.dropboxusercontent.com/u/43877103/2%C2%BA%20ESO/compuestos%20binarios.pdf
https://dl.dropboxusercontent.com/u/43877103/2%C2%BA%20ESO/cuadernillo-qu%C3%ADmica.pdf
https://dl.dropboxusercontent.com/u/43877103/2%C2%BA%20ESO/compuestos%20ternarios.pdf
No hay comentarios:
Publicar un comentario